4.8. Величини фізичної хімії і молекулярної фізикита їхні одиниці
Відповідно до стандартів [2; 17] цей підрозділ присвячено застосуванню Міжнародної системи одиниць у царинах природознавства, які належать і до фізики, і до хімії. Докладніше ознайомитися зі суто хімічними величинами та одиницями можна в [53; 61].
Згідно зі стандартами [2; 12; 13; 17; 20] з усіх величин і відповідних одиниць, за допомогою яких описують такі молекулярно-кінетичні процеси, як явища переносу, тут характеризовано лише процес дифузії (масопереносу). Величини та одиниці, що застосовуються при розгляді внутрішнього тертя (перенос імпульсу) наведено у підрозд.4.3, а теплопровідності (перенос енергії) - у підрозд.4.5.
Характеристичні числа, що є специфічним засобом вивчення явищ переносу, докладно розглянуто в гл. 5.
Величини, що застосовують при описуванні йонізаційних процесів у газах, читач знайде в підрозд.4.10
Тут у далі згідно зі стандартами [2, 17], символи хімічних елементів і речовин друкуються прямим шрифтом. Зазначимо, що стандартизовані назви та символи хімічних елементів і нуклідів наведено в дод. А.1.
У цьому підрозділі відповідно до рекомендацій стандартів [2, 17] та усталеної хімічної практики символи, які позначають речовини та їх стани, розташовано в дужках у тому самому рядку, що й основний символ, наприклад:
с(Н2О) - молярна концентрація води (у деякій суміші);
Vm(K2SO4 у H2O, 25 oC) = 0,1 дм3/моль - молярний об’єм сульфату калію у водному розчині при температурі 25 oC дорівнює 0,1 дм3/моль.
Зауважимо, що в стандартах [2, 17] з метою скорочення обсягу та з порушенням власних рекомендацій символи, що позначають речовини та їх стани, подано як підрядкові індекси, наприклад, cВ - молярна концентрація компонента В у суміші, тобто cВєc(В).
Надрядковий індекс "*" застосовано в розумінні "чистий", а надрядковий індекс "Q" – у розумінні "стандартний". Наприклад, рівність CQp,mm(H2O, g, 298,15 K) = 33,58 Дж/(K·моль) означає, що стандартна молярна теплоємність води при сталому тиску дорівнює 33,58 Дж/(K·моль), а символ l*(B, pQ) позначає абсолютну активність чистої речовини В при стандартному тиску pQ, значення якого треба вказувати окремо.
У виразах типу
![]() ,
,
(j(B) - об’ємна частка речовини В у суміші речовин Аі = А, В, С, ...; x(Aі) - молярна частка речовини Аі; V*m(Аі) - молярний об’єм чистої речовини Аі) усі молярні об’єми V*m(А), V*m(B), V*m(С), ... узято при однакових температурі та тиску, а сума в правій частині співвідношення - за всіма речовинами Аі = А, В, С, ..., з яких складається суміш, так, що
Sx(Аі) = 1
(і - номер речовини у суміші (і = 1, 2, 3, ...)), а речовина В тотожна з речовиною А2.
8-1 Відносна атомна маса - [Ar]; (relative atomic mass, относительная атомная масса) - фізична величина, що є характеристикою хімічного елемента і дорівнює відношенню середньої маси ma атома розглядуваного хімічного елемента до 1/12 маси ізотопу вуглецю-12 mC:
Ar = 12ma/mC.
Раніше для цієї величини вживали назву "атомна вага", що є неправильною і не допустимою до застосування.
Відносна атомна маса є безрозмірнісною величиною, а її одиниця - число 1.
Нагадаємо (див. підрозд. 4.3), що 1/12 маси атома ізотопу вуглецю-12 є позасистемною одиницею маси - (уніфікованою) атомною одиницею маси (u, а.о.м.).
8-2 Відносна молекулярна маса - [Mr]; (relative molecular mass, относительная молекулярная масса) - фізична величина, що є характеристикою визначеної хімічної сполуки і дорівнює відношенню маси молекули mм розглядуваної хімічної сполуки до 1/12 маси ізотопу вуглецю-12 mC:
Mr = 12mм/mC.
Відносна молекулярна маса є безрозмірнісною величиною, а її одиниця - число 1.
8-3 Число молекул чи інших структурних елементів (частинок) - [N]; (number of molecules or other elementary entities, количество молекул или других структурных единиц) - кількість молекул чи інших структурних елементів у системі. Структурними елементами системи можуть бути атоми, молекули, йони, електрони, інші частинки, або визначені групи таких частинок.
Число молекул чи інших структурних елементів є безрозмірнісною величиною, а його одиниця - число 1.
8-4 Кількість речовини - [n, n]; (amount of substance, количество вещества) - фізична величина, що дорівнює числу структурних елементів, що складають систему. Якщо однорідна система містить N структурних елементів, то її кількість речовини
n = N/NA,
де NA = 6,0221367(36)·1023 моль-1 - стала Авогадро.
Кількість речовини є основною величиною СІ, тому розмірність і одиницю їй надано довільно:
dim n = N, [n] = 1 моль.
Moль (mol, моль) дорівнює кількості речовини, що містить саме стільки структурних елементів, скільки міститься атомів у 0,012 кг вуглецю-12 (при цьому вважається, що атоми вуглецю-12 не сполучені між собою, перебувають у спокої та в своїх основних квантових станах).
Застосовуючи одиницю кількості речовини моль, слід завжди визначати, про які саме структурні елементи системи йдеться.
Рекомендовано такі кратні й частинні одиниці моля: кмоль, ммоль, мкмоль.
Детальному розгляду моля присвячено п. 3.3.6.
На основі моля утворено велику кількість питомих (молярних) величин, деякі з них наведено далі. Зауважимо, що для позначення молярних величин застосовують, як правило, підрядковий індекс "m".
8-4.1 Молярна маса - [M, m]; (molar mass, молярная масса) - фізична величина, що дорівнює відношенню маси m однорідної системи до кількості речовини n цієї системи:
M = m/n.
dim M = MN-1, [M] = 1 кг/моль.
Кілограм на моль (kg/mol, кг/моль) дорівнює молярній масі речовини, що при кількості речовини 1 моль має масу 1 кг.
До застосування рекомендовано частинну одиницю молярної маси г/моль.
Між відносною молекулярною масою Mr деякої хімічної сполуки та її кількістю речовини M існують співвідношення M/(кг/моль) = 10-3Mr або M/(г/моль) = Mr, що дуже часто застосовують на практиці при визначенні кількості речовини.
8-4.2 Молярний об’єм - [Vm]; (molar volume, молярный объем) – фізична величина, що дорівнює відношенню об’єму однорідної системи V до кількості речовини n цієї системи:
Vm = V/n.
dim Vm = L3N-1N-1, [Vm] = 1 м3/моль.
Кубічний метр на кілограм (m3/mol, м3/моль) дорівнює молярному об’єму речовини, яка при кількості речовини 1 моль охоплює об’єм 1 м3.
До застосування рекомендовано такі частинні одиниці молярного об’єму: дм3/моль, cм3/моль, допущено - позасистемну одиницю
літр на моль (l/ mol, L/ mol; л/моль): 1 л/моль = 10-3 м3/моль .
Молярний об’єм ідеального газу за стандартних (нормальних) умов ТQ = 273,15 К; pQ = 101325 Па дорівнює 0,02241410 м3/моль. Цю сталу часто застосовують у розрахунках.
8-5 Молярна термодинамічна величинa - [Xm]; (molar thermodynamic magnitude, молярная термодинамическая величина) - фізична величина, що дорівнює відношенню екстенсивного термодинамічного параметра X системи до кількості речовини n цієї системи:
Xm = X/n.
Розмірність і одиниця молярної термодинамічної величини визначаються розмірністю і одиницею розглядуваного термодинамічного параметра Х. У багатьох випадках для молярних термодинамічних величин як одиницю енергії та теплоти застосовують різновиди калорії (див. підрозд. 4.4), що не рекомендовано.
Найпоширеніші молярні термодинамічні величини наведено далі.
8-5.1 Молярна внутрішня енергія - [Um]; (molar thermodynamic energy, molar internal energy, молярная внутренняя энергия) - фізична величина, що дорівнює відношенню внутрішньої енергії U системи до кількості речовини n цієї системи:
Um = U/n.
dim Um = L2MT-2N-1N-1, [Um] = 1 Дж/моль.
Джоуль на моль (J/mol, Дж/моль) дорівнює молярній внутрішній енергії речовини кількістю 1 моль, внутрішня енергія якої 1 Дж.
Рекомендовано кратну одиницю кДж/моль.
8-5.2 Молярна теплоємність - [Cm, CV, Cp]; (molar heat capacity, молярная теплоемкость) - фізична величина, що дорівнює відношенню теплоємності однорідної системи C до кількості речовини n цієї системи:
Cm = C/n.
З огляду на те що теплоємність є водночас характеристикою системи і процесу, застосовують молярні теплоємності при постійному тиску Cp та при постійному об’ємі CV.
dim Сm = L2MT-2Q-1N-1Q-1N-1, [Сm] = 1 Дж/(моль·K).
Джоуль на моль-кельвін (J/(mol·K), Дж/(моль·К)) дорівнює молярній теплоємності речовини, що при кількості 1 моль має теплоємність 1 Дж/К.
8-5.3 Молярна ентропія - [Sm]; (molar entropy, молярная энтропия) - фізична величина, що дорівнює відношенню ентропії S системи до кількості речовини n цієї системи:
Sm = S/n.
dim Sm = L2MT-2Q-1N-1Q-1N-1, [Sm] = 1 Дж/(моль·K).
Джоуль на моль-кельвін (J/(mol·K), Дж/(моль·К)) дорівнює молярній ентропії речовини, що при кількості 1 моль має ентропію 1 Дж/К.
8-5.4 Молярна ентальпія - [Hm]; (molar enthalpy, молярная энтальпия) - фізична величина, що дорівнює відношенню ентальпії Н системи до кількості речовини n цієї системи:
Нm = Н/n.
dim Hm = L2MT-2N-1N-1, [Hm] = 1 Дж/моль.
Джоуль на моль (Дж/моль, Дж/моль) дорівнює молярній ентальпії речовини в кількості 1 моль, ентальпія якої 1 Дж.
Рекомендовано кратну одиницю кДж/моль.
8-5.5 Молярна теплота - [Qm]; (molar heat, молярное количество теплоты) - фізична величина, що дорівнює відношенню теплоти Q, наданої системі чи відібраної від неї, до кількості речовини n цієї системи:
Qm = Q/n.
dim Qm = L2MT-2N-1N-1, [Qm] = 1 Дж/моль.
Джоуль на моль (J/mol, Дж/моль) дорівнює молярній теплоті такого процесу, в якому речовині в кількості 1 моль надано теплоту 1 Дж.
Рекомендовано кратну одиницю кДж/моль.
8-6 Концентрація молекул (або частинок) - [n]; (number density of molecules (or particles), концентрация молекул) - фізична величина, що дорівнює відношенню кількості молекул N (або частинок), які містяться в об’ємі V, до цього об’єму:
n = N/V.
dim n = L-3, [n] = 1 м-3.
Метр у мінус третьому степені (m-3, м-3) дорівнює концентрації молекул (або частинок), при якій в 1 м3 міститься 1 молекула (або частинка).
8-6.1 Молекулярна концентрація (компонента В) - [C(B)]; (molecular concentration of B, молекулярна концентрация компонента В) - фізична величина, що дорівнює відношенню кількості молекул N(B) компонента В, які містяться в об’ємі V суміші, до цього об’єму:
C(B) = N(B)/V.
dim C(B) = L-3, [C(B)] = 1 м-3.
Метр у мінус третьому степені (m-3, м-3) дорівнює концентрації молекул компонента В, при якій в 1 м3 суміші міститься 1 молекула цього компонента.
8-7 Масова концентрація (компонента В) - [r(B)]; (mass concentration of B, массовая концентрация компонента В) - фізична величина, що дорівнює відношенню маси m компонента В до об’єму V суміші:
r(B) = m/V.
dim r(B) = L-3M, [r(B)] = 1 кг/м3.
Кілограм на кубічний метр (kg/m3, кг/м3) дорівнює масовій концентрації компонента B, при якій в об’ємі 1 м3 суміші міститься 1 кг цього компонента.
Допущено до застосування позасистемну одиницю
моль на літр (mol/l, моль/л): 1 моль/л = 103 кг/м3.
8-8 Молярна концентрація (компонента В) - [с(B)]; (concentration of B, amount-of-substance concentration of B, молярная концентрация компонента В) - фізична величина, що дорівнює відношенню кількості речовини n компонента В у суміші до її об’єму V:
с(B) = n/V.
dim с(B) = L-3NN, [с(B)] = 1 моль/м3.
Моль на кубічний метр (mol/m3, моль/м3) дорівнює молярній концентрації компонента В у суміші, при якій в об’ємі 1 м3 суміші міститься 1 моль цього компонента.
Рекомендовано таку кратну одиницю молярної концентрації компонента В як кмоль/м3.
Допущено до застосування позасистемні одиниці:
моль на кубічний дециметр (mol/dm3, моль/дм3): 1 моль/дм3 = 10-3 моль/м3,
моль на літр (mol/l, моль/л): 1 моль/л = 10-3 моль/м3.
Зауважимо, що у хімії молярну концентрацію іноді позначають символом [B].
8-9 Частка компонента В - [-]; (fraction of B, доля компонента В) - фізична величина, що дорівнює відношенню маси (об’єму, кількості речовини) компонента відповідно до маси (об’єму, кількості речовини) усієї системи (суміші, розчину, сплаву).
Частка компонента величина безрозмірнісна, а її одиниця - число 1.
8-9.1 Масова частка компонента В - [w(B)]; (mass fraction of B, массовая доля компонента В) - фізична величина, що дорівнює відношенню маси m(B) компонента B до маси m усієї системи:
w(B) = m(B)/m.
8-9.2 Молярна частка компонента В - [x(B), y(B)]; (molar fraction of B, молярная доля компонента В) - фізична величина, що дорівнює відношенню кількості речовини n(B) компонента B до кількості речовини n усієї системи:
x(B) = n(B)/n.
8-9.3 Молярне відношення для компонента В у розчині - [r(B)]; (molar ratio of solute B, молярное отношение для компонента В в растворе) - фізична величина, що дорівнює відношенню кількості речовини n(B) розчиненого компонента В у розчині до кількості речовини n(С) розчинника С:
r(B) = n(B)/n(С).
Для розчину з одним розчиненим компонентом В із цього визначення випливає
r(B) = х(B)/[1 - х(B)].
8-9.4 Об’ємна частка компонента В - [j(B)]; (volume fraction of B, объемная доля компонента В) - фізична величина, що визначається співвідношенням
j(B) = x(B)Vm*(B)/Sx(A)Vm*(A),
де x(B), Vm*(B) - молярна частка та молярний об’єм чистого компонента В; Vm*(А) - молярні об’єми чистих речовин А суміші при однакових температурі та тиску, S - позначає суму за всіма речовинами, що складають суміш.
Іноді замість молярних об’ємів чистих речовин А суміші для визначення об’ємної частки компонента В застосовують парціальні молярні об’єми {¶V/¶n(A)}T,p,n(B),...B),... речовин А.
8-10 Моляльність розчиненого компонента В - [mB]; (molality of solute B, моляльность растворенного компонента В) - фізична величина, що дорівнює відношенню кількості речовини n(B) розчиненого компонента В до маси m(C) розчинника C:
m(B) = n(B)/m(C).
dim m(B) = M-1NN, [m(B)] = 1 моль/кг.
Моль на кілограм (mol/kg, моль/кг) дорівнює моляльності розчиненого компонента B, при якій 1 моль розчиненого компонента B міститься в розчиннику C масою 1 кг.
Рекомендовано таку частинну одиницю моляльності: ммоль/кг.
8-11 Швидкість хімічної реакції - [x, n]; (rate of chemical reaction, скорость химической реакции) - фізична величина, що дорівнює відношенню зміни молярної концентрації dc вихідної речовини в розчині до інтервалу часу dt, протягом якого тривала реакція
x = dc/dt.
dim x = L-3T-1N, [x] = 1 моль/(м3·с).
Моль на кубічний метр-секунду (mol/(m3·s), моль/(м3·с)) дорівнює середній швидкості одномолекулярної реакції, при якій протягом 1 c молярна концентрація вихідної речовини в розчині змінюється на 1 моль/м3.
8-12 Хімічний (термодинамічний) потенціал - [m]; (chemical potential, химический потенциал) - фізична величина, що є термодинамічною функцією стану і визначає зміну термодинамічних потенціалів при зміні кількості частинок у системі. Хімічний потенціал застосовують для опису властивостей систем зі змінною кількістю частинок (відкритих систем).
Під назвою "хімічний потенціал" у різних царинах фізики та хімії часто використовують різні за визначенням величини. Так, у теоретичній статистичній фізиці та фізиці твердого тіла хімічний потенціал визначається рівностями
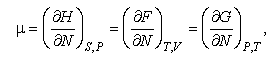
де Н, F, G – ентальпія; енергія відповідно Гельмгольца та Гіббса; N - кількість частинок у системі; параметри справа внизу біля символів частинних похідних позначають термодинамічні параметри, що вважаються незмінними (S – ентропія; p – тиск; T – температура; V - об’єм).
Кількість частинок у системі є безрозмірнісною величиною, тому з наведеного визначення випливає, що розмірність хімічного потенціалу збігається з такою для інших термодинамічних потенціалів, а його одиниця - джоуль.
Якщо використати енергією Гіббса, то отримаємо таке визначення одиниці хімічного потенціалу:
джоуль (J, Дж) дорівнює хімічному потенціалу такої системи, над якою в ізобарно-ізотермічних умовах виконується робота 1 Дж при збільшенні кількості частинок на одиницю.
У фізичній хімії та технічній термодинаміці хімічний потенціал і-го компонента гомогенної системи (або фази гетерогенної системи) також визначається як частинна похідна від будь-якого з термодинамічних потенціалів системи (фази), але за кількістю речовини ni цього компонента при постійних значеннях кількості речовини всіх інших компонентів (фаз) системи та параметрів стану, що відповідають цьому термодинамічному потенціалу.
Найчастіше як незалежні параметри використовують тиск p і температуру T, тому за визначенням як хімічний потенціал беруть парціальне молярне значення ізобарно-ізотермічного потенціалу G (енергії Гіббса).
Отже, для суміші, що містить кілька компонентів (B,C,...), дістанемо таке.
8-12.1 Хімічний потенціал компонента В - [m(В)]; (chemical potential of B, химический потенциал компонента В) - фізична величина, що визначається так:
m(В) = {¶G/¶n(B)}T,p,n(C),...(C),...
де n(C),...- позначає незмінність кількостей речовин інших компонентів суміші (С,...).
У найпростішому випадку чистої (монокомпонентної) речовини кількістю n замість цього співвідношення дістанемо
m(В) = G/n = Gm,
де Gm - молярна енергія Гіббса.
dim m(В) = L2MT-2N-1N-1, [m(В)] = 1 Дж/моль.
Джоуль на моль (J/mol, Дж/моль) дорівнює хімічному потенціалу чистої речовини, що за кількості 1 моль має енергію Гіббса 1 Дж.
8-12.2 Абсолютна активність компонента В - [l(В)]; (absolute activity of B, абсолютная активность компонента В) - фізична величина, що є функцією стану однієї речовини зі суміші кількох речовин та кількісною характеристикою реакційної здатності цієї речовини у визначених умовах.
l(В) = exp{m(В)/RT},
де m(В) - хімічний потенціал; R - молярна газова стала; Т - термодинамічна температура.
Абсолютна активність є безрозмірнісною величиною, а її одиниця - число 1.
8-12.3 Відносна активність компонента B - [a(В)]; (relative activity of B, относительная активность компонента В) - фізична величина, що дорівнює відношенню абсолютної активності l(В) речовини у заданому стані до абсолютної активності lQ(В) у стандартному стані при такій самій температурі.
a(В) = l(В)/lQ(В).
Відносна активність є безрозмірнісною величиною, а її одиниця - число 1.
8-13 Парціальний тиск компонента В (у газовій суміші) B- [p(B), pi]; (partial pressure of B in a gaseous mixture, парциальное давление) - фізична величина, що дорівнює тиску, який мав би газ, що входить до складу газової суміші, якщо б він сам охоплював об’єм усієї суміші при такій самій температурі:
p(B) = x(B).p,
де x(B) - молярна частка компонента В; p - загальний тиск газової суміші.
Розмірність парціального тиску та його одиниця паскаль збігаються з розмірністю та одиницею тиску.
8-14 Фугативність компонента В (у газовій суміші) - [f(B)]; (fugacity of B in a gaseous mixture, летучесть (фугитивность) компонента В) - термодинамічна функція, що визначається співвідношенням
![]()
де l(B), х(B) - відповідно активність і молярна частка компонента В у газовій суміші; р - загальний тиск газової суміші. Коефіцієнт пропорційності між f(B) та l(B) у цій рівності є функцією лише температури.
Розмірність фугативності збігається з розмірністю тиску, а її одиниця - паскаль.
8-15 Стандартна абсолютна активність - [lQ]; (standard absolute activity, стандартная абсолютная активность) - фізична величина, що є функцією лише температури і визначається такими співвідношеннями.
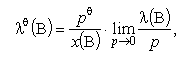
де pQ = 101,325 кПа - стандартний тиск, х(В) - молярна частка компонента В; l(В) - абсолютна активність компонента В; р – тиск.
Для компонента В у рідких чи твердих сумішах:
lQ(В) = l*(В)(pQ),
де l *(В) - абсолютна активність чистої речовини В при таких самих , що й суміш, тиску і температурі; pQ = 101,325 кПa - стандартний тиск.
Для розчиненої речовини В у розведених рідких розчинах:
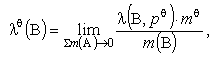
де е - сума за всіма розчиненими речовинами; l(B, pQ) - - абсолютна активність компонента В при стандартному тиску pQ = 101,325 кПa; mQ = 1 = 1 моль/кг - cтандартна моляльність; m(В) - моляльність компонента В.
Для розчинника А у розведених рідких розчинах:
lQ(А) = l*(А, pQ),
де l*(А, pQ) - абсолютна активність чистого розчинника А при стандартному тиску pQ = 101,325 кПа.
dim lQ = 1, [lQ] = 1.
8-16 Коефіцієнт активності - [f, g]; (activity coefficient, коэффициент активности) - фізична величина, що визначається такими співвідношеннями.
Для компонента В у рідких чи твердих сумішах
f(B) = l(B)/[l*(B)x(B)],
де l(B) - - абсолютна активність компонента В; l*(В) - абсолютна активність чистої речовини В за таких самих , що й суміш, тиску і температурі; x(В) - молярна частка компонента В.
Для розчиненої речовини В у розведених рідких розчинах:
f(В) = a(В)/[m(В)/mQ],
де a(В) - активність речовини В; m(В) - моляльність компонента В; mQ= 1 = 1 моль/кг - cтандартна моляльність
dim f = 1, [f] = 1.
8-17 Водневий показник, рН - [pH]; (pH value; водородный показатель, рН) - величина, що для водних розчинів, де молярні концентрації речовин не перевищують 0,1 кмоль/м3, визначається співвідношенням
pH = – lg[c(H+)g1/cQ] ± 0,02,
де c(H+) - молярна концентрація йонів водню H+; γ1 - коефіцієнт активності типового одновалентного електроліту (розчинника) у розчині (на практиці вважають g1» 1); cQ = 1 кмоль/м3 - стандартна молярна концентрація розглядуваних розчинів.
Водневий показник або рН - величина безрозмірнісна, а його одиниця - число 1.
При рН = 2 … 6 середовище називається кислим, при рН = 7 - нейтральним, а при рН = 8 … 12 - лужним.
Поза зазначеним діапазоном значень рН наведене раніше визначення цієї величини стає неточним. У цьому разі слід користуватися загальним операційним визначенням [17], наведеним далі.
Для розчину Х з невідомим рН(Х) виміряти електрорушійну силу EX гальванічного елемента, який має склад:
|| відліковий електрод || концентрований розчин KCl || розчин Х || H2 || Pt ||,
а також електрорушійну силу ES гальванічного елементу, який за складом відрізняється лише заміною розчину Х на розчин S зі стандартним значення рН(S). Тоді
pH(X) = pH(S)+( ES - EX)F/(RTln10),
де F - стала Фарадея; R - молярна (універсальна) газова стала; Т - термодинамічна температура.
Значення pH(S) є стандартизованими [32].
8-18 (Відносна) активність - [а, аm]; (relative activity, относительная активность) - фізична величина, що визначається такими співвідношеннями.
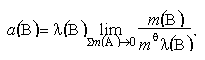
Для розчиненої речовини В у розведених рідких розчинах:
де е - позначає суму за всіма складовими суміші; m(В) - моляльність компонента В; mQ= 1 = 1 моль/кг - cтандартна моляльність; l(В) - абсолютна активність компонента В.
Для розчинника А у розведених рідких розчинах:
a(А) = l(А)/l*(А),
де l(А) - абсолютна активність розчинника А в заданому стані; l*(А) - абсолютна активність чистого розчинника А в стандартному стані при таких самих, що й розчин, температурі й тиску.
Відносна активність є величиною безрозмірнісною, а її одиниця - число 1.
8-19 Осмотичний коефіцієнт (розчинника А в розведених рідких розчинах) - [j]; (osmotic coefficient of solvent A (especially in a dilute liquid solution), осмотический коэффициент (растворителя А в разведенных жидких растворах)) - фізична величина, що визначається таким співвідношенням
j = - [M(A)еm(В)]-1·ln a(A),
де M(A) - молярна маса розчинника А; е - позначає суму за всіма розчиненими речовинами; m(B) - моляльність компонента В; a(A) - активність розчинника А.
Осмотичний коефіцієнт є величиною безрозмірнісною, його одиниця - число 1.
8-20 Осмотичний тиск - [P, p]; (osmotic pressure, осмотическое давление) - фізична величина, що дорівнює надлишку тиску, необхідного для підтримування осмотичної рівноваги між розчином та чистим розчинником, які розділено мембраною, проникливою лише для розчинника.
Осмотичний тиск має розмірність тиску і виражається в паскалях.
8-21 Стехіометричне число - [n]; (stoichiometric number, стехиометрическое число) - число або простий дріб, що є множником біля символу молекули, атома чи йона в рівнянні хімічної реакції
еn(В)B = 0,
до якої їх залучено. Тут В - зазначений символ, що відображує молекули, атоми або йони.
Згідно з домовленістю, n(В) < 0 для складових, що реагують, n(В) > 0 для продуктів реакції.
Стехіометричне число є величиною безрозмірнісною, його одиниця - число 1.
8- 22 Спорідненість (у хімічній реакції) - [A]; (affinity of a chemical reaction, химическое сродство) - фізична величина, що характеризує здатність компонентів системи вступати між собою в хімічну реакцію і визначається співвідношенням
А = - еn(В)m(В),
де е - позначає суму за всіма складовими (компонентами) реакції; n(В) - стехіометричне число компонента В; m(В) - хімічний потенціал компонента В.
Спорідненість у хімічній реакції, що відбувається при постійних температурі та об’ємі, дорівнює молярному значенню зміни DF енергії Гельмгольца системи наприкінці процесу реакції:
A = DF/n,
де n - кількість речовини системи.
dim А = L2MT-2N-1, [А] = 1 Дж/моль.
Джоуль на моль (J/mol, Дж/моль) дорівнює хімічній спорідненості компонентів системи, якщо в хімічній реакції, що відбувається при постійних температурі та об’ємі, зміна енергії Гельмгольца речовини в кількості 1 моль дорівнює 1 Дж.
8-23 Функція розподілу - [f]; (partition function, функция распределения) - фізична величина, що визначає:
для класичних систем - імовірність dw перебування системи в визначений момент часу у даній ділянці фазового простору з об’ємом dV:
f(p, q) = dw/dV,
де через q та p позначено відповідно всі координати та всі імпульси системи; dV = dq1dq2...dqsdp1dp2...dps; s - число ступенів вільності системи;
для квантових систем - імовірність dw перебування системи в якомусь стані з набору dГ можливих станів системи, щомають визначену енергію E, тобто:
f(E) = dw/dГ.
Виходячи з наведених визначень, визначити розмірність та одиницю функції розподілу неможливо. Проте в переважній більшості випадків функції розподілу нормуються на об’єм фазового простору, в якому може перебувати розглядувана класична система, або на густину станів квантової системи. У цьому разі будь-яка функція розподілу є величиною безрозмірнісною, а її одиниця - число 1.
Приклад однієї з функцій розподілу наведено далі.
8-23.1 Функція молекулярного розподілу - [q]; (molecular partitition function, функция молекулярного распределения) - безрозмірнісна величина, що визначається співвідношенням
q = еiexp(-ei/kT),
де еi - позначає суму за всіма зазначеними і-ми станами молекули; ei - енергія і-го квантового стану молекули, дозволеного при заданих об’ємі та зовнішніх полях.
8-24 Статистична вага - [g, W]; (statistical weight, статистический вес) - фізична величини, що дорівнює числу мікростанів системи, за допомогою яких можна реалізувати її макростан.
Статистична вага є величиною безрозмірнісною, а її одиниця - число 1.
Нагадаємо, що макростан системи визначено тоді, коли визначено стани кожної частинки, з яких вона складається, а макростан - коли задано значення однієї з термодинамічних функцій стану (див.підрозд.4.4). Якщо, як це й буває найчастіше, такою функцією стану обрати енергію системи, то статистичну вагу можна визначити як кратність виродженості квантового енергетичного рівня системи (див.підрозд.4.6).
8-25 Середня довжина вільного пробігу - [l]; (mean free path, средняя длина свободного пробега) - фізична величина, що дорівнює середній відстані, яку проходить молекула речовини між двома послідовними зіткненнями. Осереднення здійснюється за ансамблем молекул речовини.
Середня довжина вільного пробігу має розмірність довжини й виражається у метрах.
8-26 Коефіцієнт дифузії - [D]; (diffusion coefficient, коэффициент диффузии) - фізична величина, що визначається як коефіцієнт пропорційності у рівнянні
C(B)<v(B)> = - D gradC(B),
де C(B) - локальна молекулярна концентрація компонента В у суміші; <v(B)> - локальна середня швидкість молекули компонента В.
Якщо молекулярна концентрація компонента В у суміші змінюється лише вздовж одного напряму (осі х) і ця зміна DC(B) є рівномірною на кожному відрізку Dх, то наведене рівняння суттєво спрощується і з нього можна дістати вираз для коефіцієнта дифузії:
|D| = C(B)<v(B)>Dх/DC(B).
dim D = L2T-1, [D] = 1 м2/с
Квадратний метр на секунду (m2/s, м2/с) дорівнює коефіцієнту дифузії речовини В у такій точці суміші, де при локальній молекулярній концентрації цієї речовини 1 моль-1 та середній швидкості її молекул 1 м/с зміна молекулярної концентрації дорівнює 1 моль-1 на відрізку 1 м.
8-27 Зарядове число йона - [z]; (charge number of ion, зарядовое число иона) - фізична величина, що визначається співвідношенням
z = q/e,
де q - заряд йона, е - елементарний електричний заряд.
dim z = 1, [z] = 1
8-28 Йонний еквівалент концентрації - [Cn]; (ionic equivalent of concentration, ионный эквивалент концентрации ) - фізична величина, що дорівнює відношенню молярної концентрації с компонента до ступеня окислення n, який він виявив у відповідній сполуці:
Cn = с/n.
dim Cn = L-3N, [Cn] = 1 моль/м3
Моль на кубічний метр (mol/m3, моль/м3) дорівнює йонному еквіваленту концентрації компонента, при якому цей компонент має молярну концентрацію 1 моль/м3 і виявляє в сполуці ступінь окислення 1.
8-29 Ступінь дисоціації - [a]; (degree of dissociation, степень диссоциации) - фізична величина, що визначається співвідношенням
a = Nd/N0,
де Nd - кількість дисоційованих молекул; N0 - загальна кількість молекул.
Ступінь дисоціації є величиною безрозмірнісною, а його одиниця - число 1.
8-30 Електролітична провідність - [s , s]; (electrolytic conductivity, электролитическая проводимость) - фізична величина, що визначається співвідношенням
s =J/E,
де J - густина струму в електроліті, E - напруженість електричного поля.
dim s = L-3M-1T3I2, [s ] = 1 См/м
Cименс на метр (S/m; См/м) дорівнює електролітичній провідності електроліту, в якому електричне поле напруженістю 1 В/м спричинює струм з густиною 1 A/м2.
8-31 Молярна провідність - [Lm]; (molar conductivity, молярная проводимость) - фізична величина, що визначається співвідношенням
Lm = s/с(B),
де s - електропровідність, зумовлена компонентом В з молярною концентрацією с(B).
dim Lm = M-1T3I2N-1, [Lm] = 1 См·м 2/моль.
Сименс - квадратний метр на моль (S·m2/mol; См·м2/моль) дорівнює молярній провідності електроліту, який має електропровідність 1 См/м, зумовлену компонентом В з молярною концентрацією 1 моль/м3.
8-32 Електрохімічний еквівалент - [k]; (electrochemical equivalent, электрохимический эквивалент) - фізична величина, що дорівнює відношенню маси m речовини, яка відклалась на електроді в процесі електролізу до заряду q, який пройшов через електроліт протягом цього процесу:
k = m/q.
dim k = MT-1I-1, [k] = 1 кг/Кл.
Кілограм на кулон (kg/C, кг/Кл) - одиниця електрохімічного еквівалента, що дорівнює електрохімічному еквіваленту відкладеної на електроді речовини, маса якої після проходження через електроліт електричного заряда 1 Кл дорівнює 1 кг.
8-33 Вологість повітря - [-]; (air humidity, влажность воздуха) - характеристика вмісту водяної пари в повітрі.
8-33.1 Абсолютна вологість повітря - [f]; (absolute air humidity, абсолютная влажность воздуха) - фізична величина, що дорівнює густині водяної пари в повітрі.
Абсолютна вологість повітря має розмірність і одиницю густини речовини, тобто
dim f = L-3M, [f] = 1 кг/м3.
Практично завжди як одиницю абсолютної вологості використовують частинну одиницю 1 г/м3.
У метеорології застосовують дещо відмінне визначення абсолютної вологості:
f = 1,058·рп/(1+0,00367·t),
де рп - парціальний тиск водяної пари, виражений у міліметрах ртутного стовпчика, при температурі повітря t (у градусах Цельсія).
У цій науці загальноприйнятною є також одиниця абсолютної вологості 1 г/см3.
8-33.2 Відносна вологість повітря - [В]; (relative air humidity, относительная влажность воздуха) - фізична величина, що дорівнює відношенню абсолютної вологості повітря при даній температурі до такої абсолютної вологості, яка необхідна для отримання насиченої водяної пари за таких самих умов.
Відносна вологість повітря є безрозмірнісною величиною, а її одиниця - число 1. Найчастіше відносну вологість виражають у позасистемних відносних одиницях процентах.